
摘要
許多醫材公司在產品開發過程中,常會遇到相似的挑戰:研發團隊設計的骨科植入物在功能測試階段表現良好,卻在進入量產後頻繁遭遇良率不穩、重工比例偏高等問題。這類狀況往往並非設計功能不足,而是設計階段未充分納入製造端的實務限制。
本文探討可製造性設計(DFM)如何成為醫材產業從創新走向量產的關鍵橋樑,並透過實際製造案例說明,微小的結構調整如何對量產穩定性產生顯著影響。例如螺紋起始區的退刀設計、薄壁結構的補強方式,往往能有效改善加工良率與後段製程變形風險。
文章同時說明如何在原型階段預先辨識加工風險、透過合理的公差配置降低不必要的製造成本,以及在設計轉移階段,如何評估製造夥伴是否真正具備 DFM 實務能力。對於正在尋找 OEM 合作對象的採購主管與品質負責人,本文提供具體且可落地的評估思維,協助產品開發流程更順暢、量產風險更可控。
無論是面臨量產瓶頸的研發團隊,或正在評估新專案可行性的採購人員,建立正確的 DFM 思維,都是醫材產品在競爭市場中長期穩定量產的重要基礎。
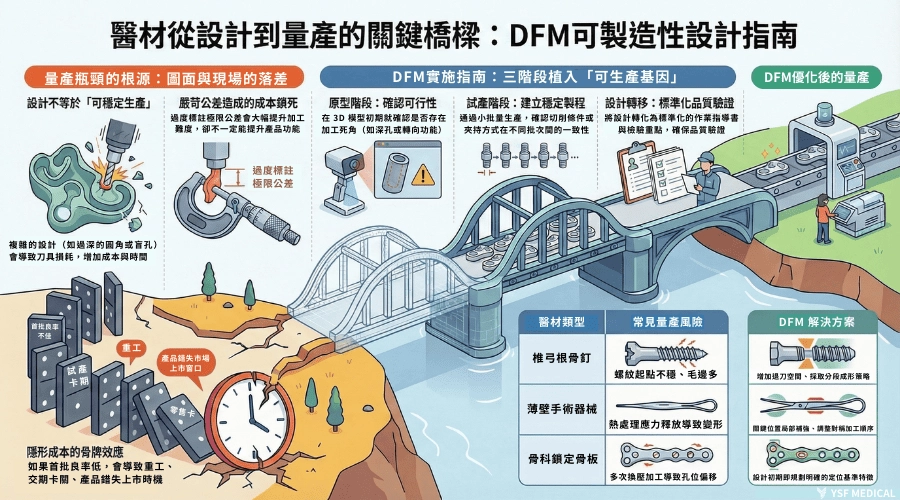
Table of Contents
1.為什麼精心設計的產品,量產時總是狀況百出?
很多醫材專案在開發前期其實進行得很順,圖面審查過了,功能驗證也沒有問題,看起來一切都照計畫走。但一進入試產,狀況就開始接連出現。螺紋怎麼調都不好加工,壁厚一進熱處理就開始變形,原本只是想把規格標清楚的公差,最後卻讓加工時間拉長、成本快速堆高。
1.1 試產才出問題,通常已經太慢
這些狀況往往不是設計「錯了」,而是設計時沒有真的站在製造現場想過,這些結構要怎麼被穩定地做出來。等到試產才發現卡關,能調整的空間已經不多,修改帶來的時間與成本壓力,也開始變得明顯。
1.2 很多量產風險,其實在設計階段就已經埋下
螺紋深一點、壁厚厚一點,在設計當下看起來只是保守一點的選擇,但到了實際加工與後續製程,這些細節往往會被放大成良率不穩、交期延誤,最後變成整個專案必須承擔的風險。
2.DFM 不是修改設計,而是讓產品具備「可生產基因」
DFM(Design for Manufacturability)常常被誤解成是在要求研發團隊為了製造而妥協設計或功能,但在多數醫材專案中,真正有效的 DFM 並不是推翻原本的設計,而是把製造端長期累積的實務經驗提早帶進來。在不影響臨床功能的前提下,協助設計團隊避開那些「圖面上看不出來,但量產一定會出問題」的細節。
我們通常把這個過程形容為替產品植入「可生產基因」,讓設計在一開始就具備穩定量產的條件,而不是等到試產後,再用時間與成本慢慢修正。
2.1 製造端在看什麼,往往和設計端想的不一樣
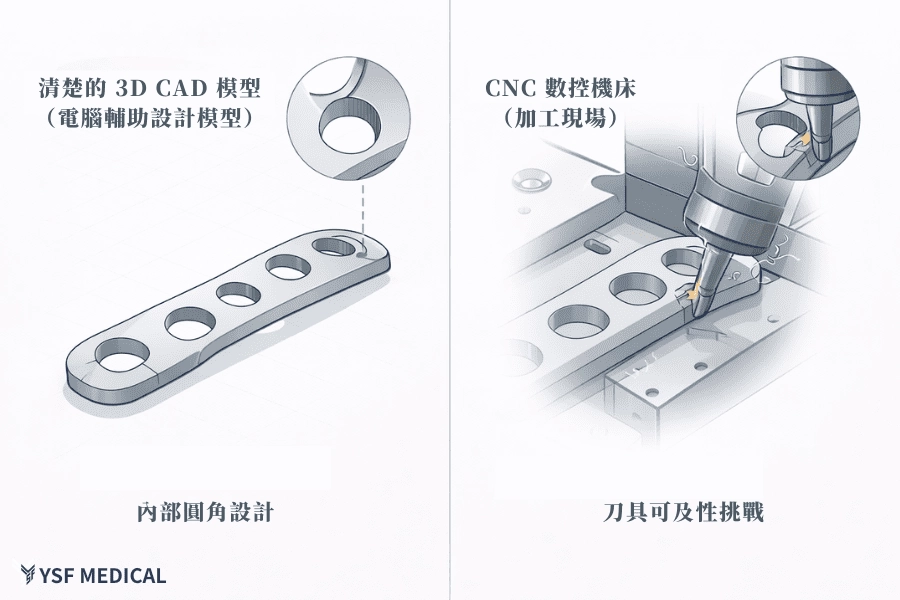
當設計圖出現內凹圓角、深孔或複雜的鏤空結構時,製造端第一個思考的,通常不是「能不能做」,而是「這個結構能不能穩定加工」。舉例來說,研發團隊可能會認為「R0.5 的內圓角已經夠大了」,但製造端第一時間想的是「市面上能穩定加工這個半徑的球刀,最小直徑是多少?刀具壽命能撐幾件?」這類問題在 3D 模型上完全看不出來,卻會直接影響量產時的刀具成本與加工節拍,這些問題在圖面審查階段往往不明顯,卻會在試產時快速浮現。
以脊椎椎間融合器為例,內部結構若沒有預留足夠的加工空間,即使採用銑床加工,實際製程中仍可能產生死角,導致毛邊不易清除,或在後續使用中形成潛在的應力集中點。這類問題一旦發生,通常需要反覆修改製程,甚至回頭調整設計。
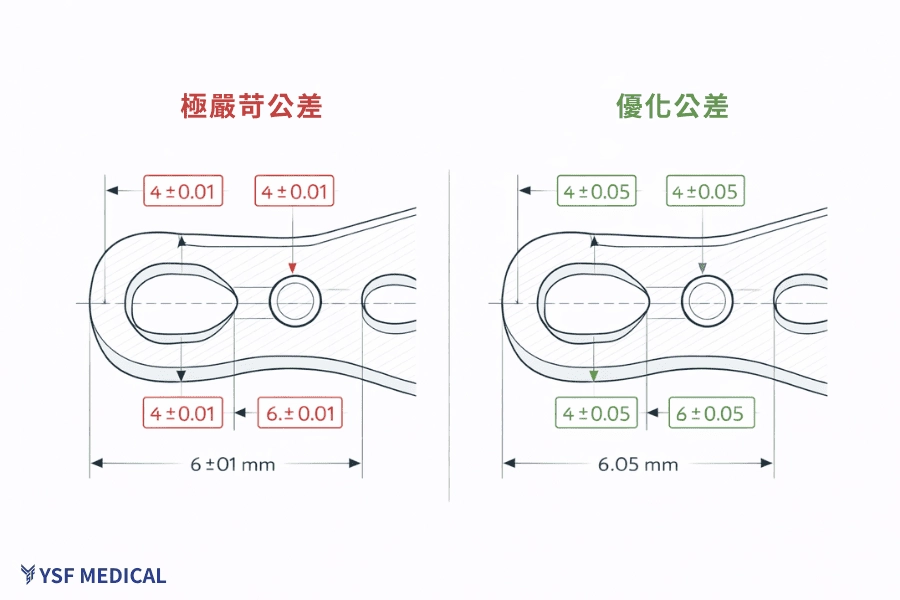
2.2 公差標得越嚴,不一定代表產品會更好
在設計階段,將所有尺寸標註為極限公差,看起來像是在為品質把關,但在製造端,這往往意味著加工時間拉長、檢測工序增加,甚至必須使用超出實際需求的設備規格。
DFM 的重點不在於一味放寬公差,而是在設計階段就協助釐清哪些尺寸真的會影響組裝配合或臨床表現,哪些尺寸即使稍微放寬,對功能其實沒有實質影響。透過這樣的取捨,才能在品質、成本與量產穩定性之間取得比較合理的平衡,而不是等到量產後才發現成本已經被設計鎖死。
2.3 定位基準沒想清楚,後面每一道製程都在冒險
以骨科鎖定骨板這類零件來說,往往需要多次換面加工,才能完成螺絲孔、螺紋與表面特徵加工。如果在設計時沒有清楚規劃定位基準,每一次重新夾持都可能產生微小偏移,單次看似影響不大,累積起來卻會造成孔位精度不穩,進而影響組裝與品質一致性。
DFM 會在設計階段就提醒是否需要增加定位特徵或基準結構,讓後續製程能夠穩定重複。這樣的前期規劃,不只是在幫助加工,也能讓後續的製程驗證與品質確認流程進行得更順,避免在量產前才被迫大幅調整製程條件。
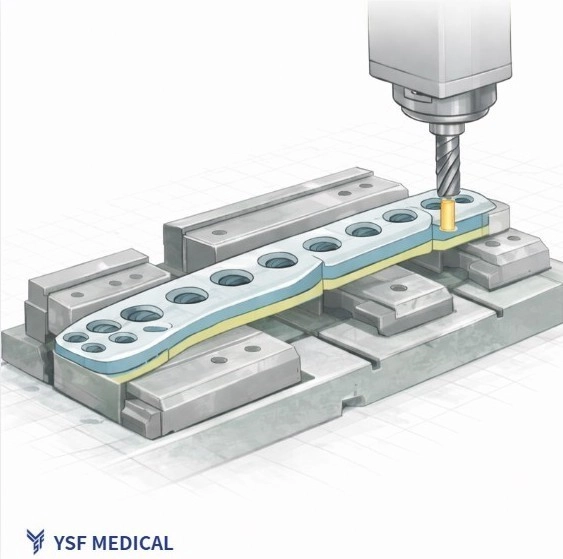
3.忽視 DFM 帶來的隱形成本:從良率到上市時程的骨牌效應
當產品設計在缺乏製造可行性評估的情況下就直接進入試產,問題往往不會一次爆開,而是一步一步浮現。剛開始看起來只是良率偏低、加工不順,接著重工次數增加、驗證卡關,最後連產品上市時程都被拖慢。
這些成本很少在一開始就被完整計算,但在專案後期,卻會以「不得不承擔」的方式,一項一項堆疊出來,形成難以逆轉的骨牌效應。
3.1 首批良率不穩,往往是後面問題的起點
在骨科醫材中,原材料本身就佔了製造成本的相當比例。一旦試產階段的首次通過良率偏低,代表每一批產品中,都有相當數量必須報廢或重工。這不只是材料浪費,更會直接拉長加工時間、佔用產線資源。
以細長結構的鈦合金骨釘為例,若設計階段未考量刀具剛性與加工穩定性,實際加工時很容易出現震動或表面品質問題。即使後續嘗試調整切削條件,許多零件在早期就已承受內部應力,往往很難完全補救。這類情況一旦在試產才被發現,後續每一個製程調整,成本都會被放大。
3.2 良率不穩如何連鎖影響驗證與上市時程
良率無法穩定控制時,問題會直接延伸到品質系統與法規驗證流程。醫材產品在量產前必須完成設計轉移與製程確效,但當製造風險尚未被消除,設備穩定度不足、製程參數無法建立合理操作範圍、批次間變異過大,原本應用來「確認可量產狀態」的驗證活動,反而變成反覆嘗試與補救的過程。驗證次數增加,工程人力與時程被持續消耗,試產與設計修改同步拉長專案節奏,夾治具需反覆調整,加工程式重新修正,尺寸一致性必須重驗。當驗證卡關成為常態,產品上市時程自然被一再延後,在競爭激烈的醫材市場中,錯過窗口往往難以追回,即使設計已完成,只要基礎製程無法穩定,製程能力驗證仍難順利推進,產品也難真正進入市場。
4.DFM 實施指南:從原型到量產的三階段檢核
將 DFM 納入產品開發流程,並不是額外增加工作,而是在既有節點中,讓製造端能夠提早參與討論。實務上,真正有價值的 DFM,往往不是一次性的審查,而是隨著專案推進,在關鍵時刻把製造的觀點拉進來,幫助團隊在設計尚未完全定案前,就先避開後面一定會放大的風險。
這樣的做法,能讓產品從原型走向量產時少走很多彎路,也讓後續的試產與驗證過程更可控。
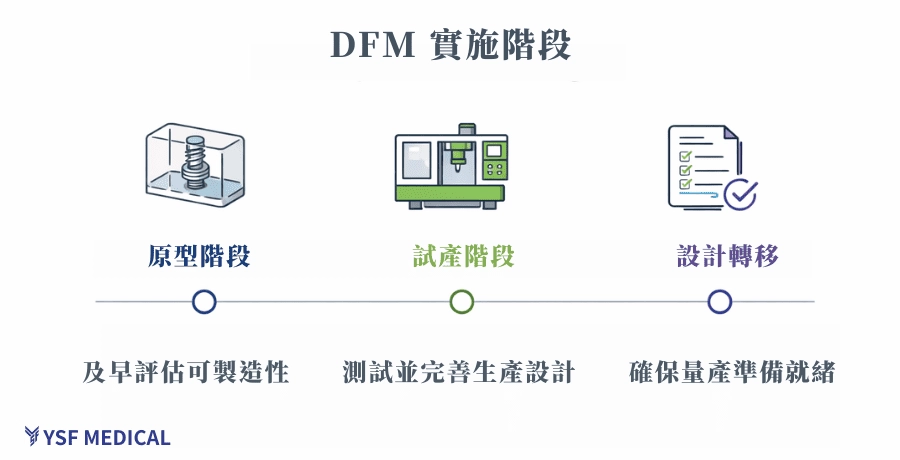
4.1 雛型品階段:先確認「做不做得出來」,再談優化
當研發團隊完成初步的 3D 模型時,這往往是製造端最容易提供關鍵回饋的時機。此時的重點,不是把設計改到完美,而是先確認是否存在會讓量產變得困難的結構,例如過深的盲孔、無法一次完成的複雜曲面,或需要非常特殊刀具才能加工的內部特徵。 以骨科骨釘為例,如果雛型品設計中的曲面或角度已經接近設備的加工極限,製造端通常會在這個階段提醒是否需要調整曲率,或評估分段加工的可行性。這樣的即時回饋,能讓研發團隊在還有彈性的時候做調整,而不是等到試產後才發現方向需要大幅修正。
4.2 試產階段:確認製程能不能穩定重複
進入小批量試產後,DFM 的角色會轉向協助建立一套「能重複、能預期」的製程條件。這個階段,製造團隊會透過實際加工與量測,確認目前的切削條件、夾持方式與檢驗方法,是否能在不同批次間維持一致的表現。
當某些尺寸的變異特別明顯時,經驗通常會回到幾個常見原因,例如夾持不穩、刀具磨耗過快,或熱影響導致尺寸漂移。這時候,DFM 的價值不只是調參數,而是協助判斷問題到底該由製程修正,還是需要回頭重新檢視設計與公差設定,避免把不穩定的狀態一路帶進量產。
4.3 設計轉移階段:讓品質驗證變成確認,而不是救火
如果產品在進入設計轉移前,已經透過 DFM 把主要的製造風險處理過,後續的品質系統驗證流程會相對順利。相反地,若設計本身仍存在明顯的製造不確定性,設計轉移與製程驗證階段往往會變成反覆補救的過程。
在實務上,DFM 會協助把設計圖面轉換成製造與品質部門真正能執行的內容,例如清楚的作業指引、檢驗重點與管制方式。以常見的螺紋結構為例,除了圖面尺寸外,還需要提前定義檢驗方式、刀具管理原則,以及不合格狀況的判定邏輯。當這些細節在設計階段就被討論清楚,後續的製程驗證會更像是在確認結果,而不是一邊驗證、一邊修改。
5. 從理論到實務:骨科醫材加工的 DFM 案例解析
相較於原則性的說明,實際案例更能反映 DFM 在製造現場的真實價值。以下兩個案例,來自製造端實際參與國際醫材品牌量產導入與設計轉移過程中的經驗,內容已完成去識別化處理,重點不在成果數字本身,而在於說明製造視角如何在設計階段,就提前化解後續量產風險。
5.1 案例一:椎弓根骨釘螺紋加工的穩定性改善
5.1.1 製造端如何察覺問題
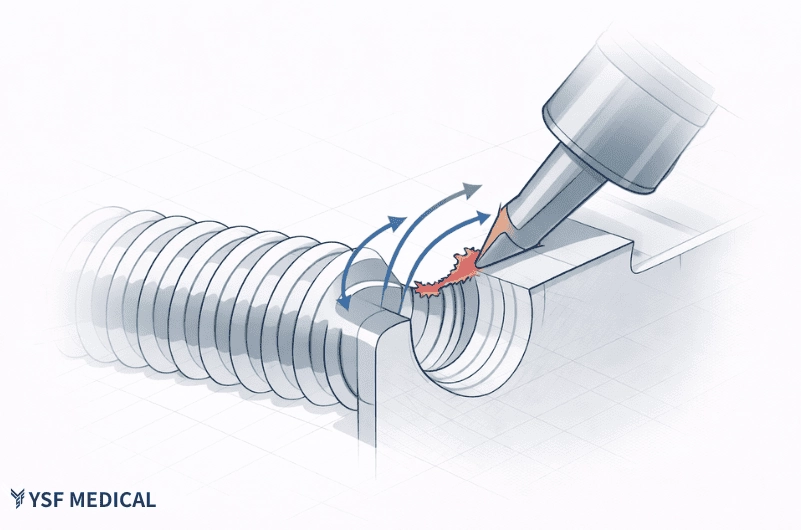
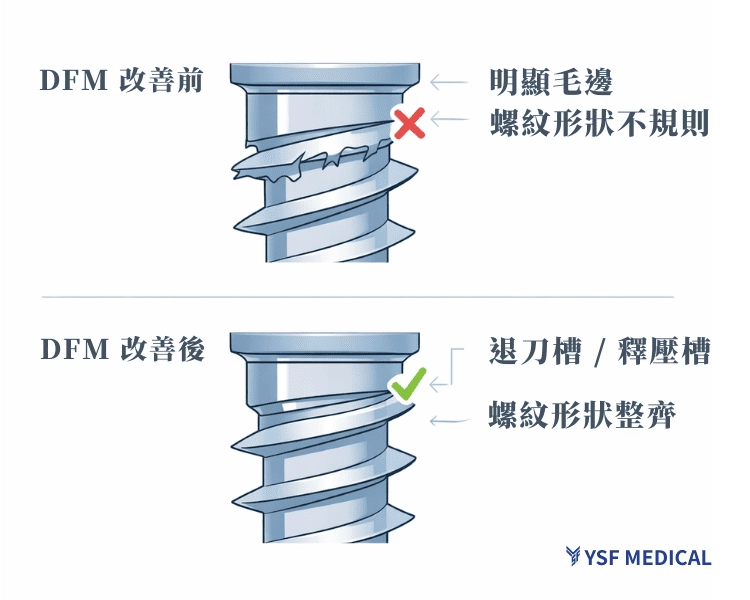
在某款椎弓根骨釘(Pedicle Screw)的試產過程中,製造端注意到螺紋起始區反覆出現毛邊與起始牙形不穩的狀況,同時螺紋外徑在不同批次間的尺寸波動偏大。
這類問題在單件打樣或功能驗證階段不一定明顯,但一旦進入連續加工與批次量測,就會快速放大成良率壓力,導致試產階段需要投入相當比例的重工與報廢處理。
5.1.2 DFM 介入的設計與製程調整重點
進一步檢視後,團隊將問題收斂至兩個常見但容易被忽略的設計與製程交界點。
第一,螺紋起始端缺乏足夠的退刀空間,使刀具在進退刀時承受額外切削負荷,毛邊與起始牙形不完整因此反覆出現。
第二,原本的螺紋成形策略偏向一次到位,對鈦合金材料而言,彈性回復與刀具磨耗會讓尺寸一致性更難穩定控制。
在不影響臨床功能與配合條件的前提下,DFM 建議於螺紋起始端納入退刀相關的設計考量,並調整為較溫和、分段的成形方式,讓尺寸逐步收斂,而非集中在單一道工序完成。
5.1.3 首批良率不穩,往往是後面問題的起點
在骨科醫材中,原材料本身就佔了製造成本的相當比例。一旦試產階段的首次通過良率偏低,代表每一批產品中,都有相當數量必須報廢或重工。這不只是材料浪費,更會直接拉長加工時間、佔用產線資源。
以細長結構的鈦合金骨釘為例,若設計階段未考量刀具剛性與加工穩定性,實際加工時很容易出現震動或表面品質問題。即使後續嘗試調整切削條件,許多零件在早期就已承受內部應力,往往很難完全補救。這類情況一旦在試產才被發現,後續每一個製程調整,成本都會被放大。
5.2 案例二:手術器械薄壁結構的變形風險預防
5.2.1 問題為何在熱處理後才浮現
某款骨科手術器械為了達到輕量化需求,採用了相對薄的結構設計。在粗加工階段並未觀察到明顯異常,但進入熱處理後,零件開始出現翹曲變形,導致後續精加工與組裝階段頻繁發生配合不良的狀況。
即使透過後加工嘗試修正,變形仍難以穩定控制,組裝良率始終無法達到預期。
5.2.2 DFM 如何重新檢視結構與製程順序
製造端與設計團隊共同回顧製程後發現,問題並非熱處理條件本身,而是薄壁區域在前段加工時已累積殘留應力,並在熱循環過程中被集中釋放。DFM 的介入方向並不是單純加厚結構,而是在不影響整體重量與功能需求的前提下,於關鍵位置增加局部補強,同時重新安排對稱特徵的加工順序,讓應力釋放更均勻。
5.2.3 改善後對組裝與交期的實際影響
改良後的結構在熱處理後的尺寸穩定性明顯提升,組裝階段的干涉問題大幅降低,交付流程也隨之順暢。更重要的是,這次經驗被整理成薄壁結構設計的內部準則,讓後續開發的相似器械能直接參考,避免再次重複付出試錯成本。
5.3 從案例回看 DFM 真正的角色
回顧前面兩個案例,可以發現問題並不是加工技術不足,而是設計階段少了一次製造視角的檢視。無論是螺紋起始結構,還是薄壁區域的應力分佈,這些風險其實在圖面階段就已經有跡可循,只是當下往往不會被特別注意。
DFM 的價值,也正是在這裡發揮作用。它不是為了追求極端數據或炫耀成果,而是幫助專案在設計走向量產的過程中,少一點意外、多一點可預期性,讓團隊不必為同樣的問題反覆付出時間與成本。
在與醫材採購及研發團隊的實際互動中,我們發現許多企業對可製造性設計存在相似的疑慮,以下整理五個最常被詢問的問題,並提供實務觀點的解答。
1. 現在這個設計,看起來都能加工,還需要特別做 DFM 嗎?
很多量產問題,並不是「做不做得出來」,而是「能不能穩定地一直做」。 在圖面階段,絕大多數設計看起來都可以加工,但真正的差別,往往在於加工過程是不是容易累積誤差、後段製程會不會放大風險、檢測與驗證能不能順利進行。
如果一個設計在早期就需要大量依賴經驗調整或特殊操作,通常代表它在量產時的風險會比較高。DFM 的角色,就是在這個階段幫你把這些「現在還看不太出來的問題」提早攤開來看。
2.這個設計現在看起來沒問題,真的需要現在就花時間討論製造風險嗎?
很多專案在早期都會有一個共通想法:「等試產再看就好」。但實務上,等問題真的在試產階段浮現時,能調整的往往只剩製程參數,而不是設計本身。 真正值得提早討論的,不是現在能不能加工,而是這個設計在放大量產後,會不會對夾持、刀具、檢測或後段製程造成累積風險。
如果一個設計在早期就需要依賴大量經驗調整、特殊操作或人工判斷才能完成,通常代表它在量產時的穩定性會比較低。DFM 的價值,就在於協助團隊在設計還有彈性的時候,把這些潛在的不確定性先看清楚,而不是留到後面再被迫修正。
3.製造端建議調整設計,我怎麼知道會不會影響產品功能?
這是非常常見、也很合理的顧慮。關鍵不在於「要不要改」,而在於改的是哪一種東西。實務上,多數 DFM 建議是在處理加工穩定性、定位方式或製程順序,而不是臨床功能本身。如果能先把哪些尺寸或結構是「功能不可動」、哪些屬於「製造彈性區」講清楚,討論會順很多。
與其等到試產後才被迫在功能與製造之間取捨,不如在設計階段就先把界線畫清楚,讓後續的建議更聚焦。
👉如果你現在正卡在「製造建議很多,但不知道哪些能接受」的狀態,通常代表這個設計已經進入適合做 DFM 討論的時機點。
歡迎與元信豐聯繫,我們可以協助你一起釐清哪些調整真的有助於量產穩定與品質控管。請填寫聯絡表單,或直接來信至 sales@ysfbone.com。
4.產品是小批量或客製化的,也需要花時間做 DFM 嗎?
越是小批量或客製化,越需要把第一次做對。這類專案通常沒有太多試錯空間,一次加工失敗,不只是成本問題,也會直接影響交期與專案信任度。DFM 在這裡的重點,不是優化效率,而是幫你判斷哪些地方最容易出問題,哪些地方值得多留一點安全空間。
很多客製化專案真正的風險,不在設計複雜,而在於「複雜到超出設備或製程的可控範圍」,而這往往只有從製造端視角才能看得出來。
5.如何評估製造夥伴是否具備真正的 DFM 能力?
在評估製造夥伴時,DFM 能力往往不是寫在型錄或簡報裡,而是體現在討論過程中。 一個具備實務經驗的團隊,通常不會只看圖面尺寸,而是會主動詢問產品的臨床使用情境、關鍵功能需求、預期產量,以及哪些地方在量產時最不能出問題。
實際判斷時,可以觀察對方提出的回饋是否夠具體,例如是否能指出潛在的加工瓶頸、夾持與定位風險、後段製程可能放大的不確定性,並說清楚這些問題「為什麼會發生」。如果討論重點始終停留在「能不能做」或「怎麼改圖」,而沒有延伸到量產穩定性與驗證可行性,通常代表 DFM 能力仍停留在表層。真正有 DFM 能力的製造夥伴,會在問題還沒發生前就提醒你哪些地方值得多想一步,協助你在設計與製造之間做出更有餘裕的決策。
👉 如果你正在評估醫材專案的量產可行性,或希望在設計定案前先確認潛在製造風險,歡迎來信sales@ysfbone.com與元信豐聯絡,我們可以從製造端的實務角度,陪你一起把問題提早看清楚。
醫療器材產業的競爭關鍵,來自於設計能否被穩定地轉化為可量產、可驗證、並能長期供應的產品。在市場節奏持續加快、開發風險逐漸提高的環境下,製造可行性已成為影響產品能否順利商業化的重要基礎條件。
DFM 所帶來的價值,體現在開發流程中對不確定性的提早掌握。當設計階段就能納入製造端的實務觀點,後續在設計轉移、製程驗證與供應規劃上的決策會更加清楚,專案推進的節奏也更穩定。這樣的工程思維,有助於減少反覆修正所產生的時間與資源消耗,讓產品能以更可控的方式推進至量產階段。
對採購主管與品質負責人而言,製造夥伴是否具備成熟的 DFM 經驗,直接影響產品供應的穩定性與整體專案風險的可控程度。當製造端能在早期就協助辨識潛在問題,整個開發與供應流程自然會更加順暢。將可製造性納入產品開發的核心思考,有助於讓醫療創新以更穩定的節奏,從設計階段逐步走向臨床應用與市場。
8.1 從代工角色,轉向工程協作的工作方式
在實務上,許多加工問題其實早在設計初期就已經存在,只是未必會被立即察覺。當設計逐步定案、製程選擇開始收斂後,能夠調整的空間往往已經相當有限。
元信豐的製造工程團隊在收到初步設計資料後,會先從製造端角度進行可加工性的初步檢視,聚焦於量產時最容易卡關的環節,例如結構是否具備穩定加工條件、公差配置是否符合實際製程能力,以及材料特性在後段製程中可能帶來的影響。這些回饋能協助團隊提早掌握製造時需要留意的重點,讓後續判斷更有依據。
透過這樣的工程討論,設計團隊能在仍保有調整彈性的階段,就理解製造端可能遇到的限制與取捨,減少試產或量產後問題集中出現的情況,使整體專案推進更加穩定。
8.2 專注脊椎與創傷系統,累積可複製的工程經驗
元信豐長期專注於脊椎植入系統與創傷固定器械,包括融合系統、各式骨釘、鎖定骨板等高精度鈦合金、醫療級不鏽鋼、PEEK材質的植入物。這類產品的共通特徵,在於材料強度高、公差要求嚴、幾何結構複雜,且往往涉及多道加工與後處理流程,也正是最容易在量產階段放大製造難度的產品類型。
在長期參與這類專案的過程中,我們逐漸累積的是對「哪些設計在製造時容易出問題」的實務判斷。相較於單一專案的加工經驗,我們更重視將這些判斷整理成可重複應用的工程思考方式,讓後續專案在設計階段就能避開已知的風險區域。
無論是不同材料在加工時的行為差異,或是結構設計對製程穩定性的影響,這些經驗都能在專案早期被納入考量,讓設計與製造之間的討論更貼近實際現場,減少後續反覆試錯的情況。
8.3 立即開始您的製造可行性評估
總而言之,DFM 並不是要在設計上做更多事情,而是幫助團隊在正確的時間,看見原本就存在的製造現實。當設計與製造之間能提早對齊,許多量產階段才爆發的問題,其實根本不必發生。對製造端而言,能夠把這些經驗如實回饋給客戶,讓專案少走幾次彎路,正是我們在每一個合作中最重要的價值所在。
如果您正在尋找值得信賴的醫材CNC加工夥伴,歡迎與元信豐聯繫。填寫聯絡表單或來信至 sales@ysfbone.com,我們的團隊將在24小時內與您聯繫。
關於元信豐的技術能力與成功案例,歡迎造訪我們的設計開發服務頁面,了解完整的工程支援方案,讓我們成為您將創新概念轉化為市場產品的可靠夥伴,一起縮短從研發到量產的距離,在競爭激烈的醫材市場中建立持久優勢。
9.聲明
本文內容僅供醫療器材產業專業人士參考之用,文中所提供的技術資訊、加工建議與產業分析均基於公開資料與專業經驗整理而成,由於醫療器材製造涉及複雜的技術規範與法規要求,實際應用時仍需依據具體產品特性、使用環境及相關法規進行專業評估。
本文不構成任何形式的專業諮詢建議,對於加工方式的選擇、設備投資決策或供應商評估,建議讀者諮詢具備相關資質的技術顧問或法規專家,文中提及的精度數據、加工參數與時程估算僅供參考,實際結果可能因材料特性、設備狀況、操作環境等因素而有所差異。
作者已盡力確保內容的準確性與時效性,但醫療器材產業技術與法規持續演進,部分資訊可能隨時間推移而需要更新,對於因使用本文資訊而產生的任何直接或間接損失,作者不承擔法律責任。
文中案例數據已進行去識別化處理以保護客戶隱私,所有涉及具體產品的描述均已獲得適當授權或改編為通用情境,任何與實際案例的相似之處純屬巧合。
如有任何疑問或需要進一步的技術支援,歡迎透過官方管道聯絡專業團隊進行諮詢。
10.參考資料
American Society for Quality. (2024). Process capability index (Cpk). ASQ.
https://asq.org/quality-resources/process-capability
Boothroyd, G., Dewhurst, P., & Knight, W. A. (2011). Product design for manufacture and assembly (3rd ed.). CRC Press.
https://doi.org/10.1201/9781420089288
European Commission. (2023). Medical Device Regulation (MDR) 2017/745. European Commission.
https://health.ec.europa.eu/medical-devices-sector/new-regulations/guidance-mdcg-endorsed-documents-and-other-guidance_en
International Organization for Standardization. (2016). Medical devices — Quality management systems — Requirements for regulatory purposes (ISO 13485:2016). ISO.
https://www.iso.org/standard/59752.html
International Organization for Standardization. (2024). Design for manufacturability (DFM). ISO Online Browsing Platform.
https://www.iso.org/obp/ui
Malloy, R. A. (2010). Plastic part design for injection molding: An introduction (2nd ed.). Hanser Publications.
https://www.hanserpublications.com/fachbuch/artikel/9783446404687
Pahl, G., Beitz, W., Feldhusen, J., & Grote, K. H. (2007). Engineering design: A systematic approach (3rd ed.). Springer.
https://link.springer.com/book/10.1007/978-1-84628-319-2
U.S. Food and Drug Administration. (2023). Design control guidance for medical device manufacturers. FDA.
https://www.fda.gov/medical-devices/postmarket-requirements-devices/design-control-guidance-medical-device-manufacturers
U.S. Food and Drug Administration. (2024). Premarket approval (PMA). FDA.
https://www.fda.gov/medical-devices/premarket-submissions-selecting-and-preparing-correct-submission/premarket-approval-pma
U.S. Food and Drug Administration. (2024). Process validation: General principles and practices. FDA.
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/process-validation-general-principles-and-practices
Whitney, D. E. (2004). Mechanical assemblies: Their design, manufacture, and role in product development. Oxford University Press.
https://global.oup.com/academic/product/mechanical-assemblies-9780195157826?cc=tw&lang=en&
Zhang, H. C., & Huang, S. H. (1995). Applications of neural networks in manufacturing: A state-of-the-art survey. International Journal of Production Research, 33(3), 705-728.
https://doi.org/10.1080/00207549508930175
© 2026 元信豐企業股份有限公司 |骨科植入物及手術器材製造專家、ISO 13485 認證醫材廠、CNC 精密加工 |引用或轉載請註明來源,版權所有。
.webp) 聯絡我們
聯絡我們


.webp) 聯絡我們
聯絡我們

